Parfois, il faut se retrousser les manches et parler des sujets importants. Les plantes sont-elles assez formidables pour que les animaux tentent de leur ressembler ? Dans une collaboration loufoque avec Pierre Kerner, dans l’épisode #ps433 de Podcast Science, nous enquêtons sur l’affaire. Cliquez sur l’image pour écouter l’épisode sur le site de Podcast Science.

Manger l’énergie solaire : un super pouvoir made in Plants
Ce n’est sûrement pas un scoop pour vous, mais ce qui fait qu’une plante est une plante, c’est avant tout sa capacité à utiliser l’énergie du soleil grâce à la réaction de photosynthèse, qui permet de convertir de l’eau, du dioxyde de carbone et des photons en molécules organiques : sucres, vitamines, et autres produits capitaux pour l’alimentation de tout être vivant qui se respecte. On résume cette réaction par la très célèbre équation chimique simplifiée suivante :
6 CO2 + 6 H2O —› C6H12O6 + 6 O2
Le détail de cette réaction ne sera pas détaillé dans cet article, mais vous pouvez en avoir un aperçu dans ce fil twitter. Elle repose en grand partie sur un pigment, la chlorophylle qui rend les plantes… vertes. Pour tout savoir sur ce pigment, rendez-vous dans cet article.
La chlorophylle est stockée dans un compartiment spécifique, un organite de la cellule végétale, que l’on appelle le plaste. Et plus précisément, un chloroplaste, puisqu’il contient la chlorophylle, c’est logique.
Les plastes peuvent être de plusieurs types chez les plantes et se différencient à partir d’un pro-plaste dont la fonction n’est pas encore déterminée. En plus des chloroplastes on retrouve par exemple les chromoplastes contenant les pigments autres que la chlorophylle (caroténoïdes…), les leucoplastes qui produisent des métabolites secondaires comme des résines ou des huiles, les amylopastes qui permettent le stockage de l’amidon et les étiplastes… qui sont des chloroplastes un peu raplalas et pâlots lorsque la plante n’a pas de lumière. Ces plastes peuvent, dans certains cas s’interconvertir, changeant de fonction au cours du développement des organes de la plante. Il y a même un nom pour les plastes entrain de mourir dans les plus vieux organes des végétaux : les gérontoplastes ! (1)
Et si on creuse très loin, on trouve même des desiccoplastes, des bizonoplastes que l’on retrouve uniquement chez une espèce de Sélaginelle (2), des iridoplastes se comportant comme des cristaux qui rendent les plantes iridescentes (3) , des tannoplastes qui permettent de fabriquer et d’aggréger les tannins en petites vésicules transportables dans les cellules (4) et des phényloplastes qui permettent par exemple de fabriquer et de stocker la subtile odeur de la vanille (5).

Depuis quand ça existe les plastes ?
En voilà une bonne question ! Si on parle depuis une perspective historique, le premier plaste observé est attribué à Anthony van Leeuwenhoek, le drapier néérlandais qui révolutionna l’observation microscopique en 1674. Il en fit l’observation en regardant le chloroplaste en spirale d’algues du genre Spirogyra. (6)

Le terme « plaste » (« plastid ») en anglais, a été proposé en 1883 par Andreas Franz Wilhelm Schimper et dérive directement du grec « plastikos » évoquant le modelage, pour signifier que ces compartiments étaient plastiques et changeaient de formes au cours du temps.
En observant leurs caractéristiques précises, on se rend compte que tous les plastes ont une double membrane, à l’intérieur de la cellule. La théorie en vigueur est qu’une cellule eukaryote ait avalé une cyanobactérie photosynthétique sans la dégrader, que celle-ci se soit maintenue lors d’un évènement communément appelé « endosymbiose primaire ». De cette cellule aurait dérivé l’ensemble des représentants des plantes, des algues vertes, et rouges. Des endosymbioses dites secondaires auraient ensuite eu lieu, pour donner des organismes dotés de plastes à 3 ou 4 membranes, comme l’illustre ce dessin tiré d’une publication de 2001. (7)

Chez les algues rouges encore, les rhodophytes, on retrouve également des plastes contenant des pigments rouges comme la phycoérhytrine, on parle de rhodoplaste. Il y a de la créativité côté plastes !
Ciel, mon chloroplaste !
Mais revenons-en à nos moutons et reparlons des plastes les plus utiles aux plantes, les chloroplastes. La photosynthèse a lieu dans les repliements internes du chloroplaste, que l’on appelle les thylakoïdes et qui renferment les pigments photosynthétiques. En suspension, les chloroplastes contiennent leur propre information génétique, dont l’instruction est réduite à son minimum et partiellement sous le contrôle des gènes du noyau de la cellule dans laquelle il est enfermé.

Ce petit bijou de technologie biologique permettant le processus de la photosynthèse est tellement génial (avouez que ce serait pratique de se nourrir de soleil et d’eau fraîche), que l’on retrouve des associations et des pactes entre plantes et animaux. Entre organismes photosynthétiques et non-photosynthétiques.
Un exemple répandu est celui de la salamandre, Ambystoma gracilis. Deux fois par an, elles émergent pour pondre dans des bassins d’eau et leurs oeufs seront colonisés par des algues. Les oeufs ainsi envahis grandissent plus vite et deviennent plus gros, profitant d’un surplus gratuit d’oxygène, mais l’association n’est pas obligatoire. L’algue elle-même semble y trouver son compte, en utilisant les déchets azotés excrétés par les embryons. Il semblerait également que l’algue puisse envahir les tissus de la salamandre au cours du développement, les réponses immunitaires de cette dernière étant adaptées pour permettre à son invitée de rester. (8,9,10)

Les coraux comme ce Galaxea fascicularis fournissent dans les basses profondeurs le gîte pour des zooxanthelles, des organismes unicellulaires capables de photosynthèse qui fourniront en échange jusqu’à 90% de la nourriture nécéssaire à la vie du corail. Une symbiose aux bénéfices réciproques que l’on espère pouvoir voir continuer, malgré la destruction des récifs coraliens. (11)

Et chez les lichens tels que les Peltigera, le pacte est conclu entre des champignons, des cyanobactéries ou des algues unicellulaires. Ceux capables de photosynthèse fournissent le couvert, la protection du champignon permet à l’algue de s’affranchir de son milieu aquatique et de coloniser de nouveaux milieux ! Les associations sont nombreuses et le monde de la lichénologie complexe mais passionnant.

Pour certains, ce pacte est transgressé pour littéralement devenir… du vol ! C’est là qu’on parle de kleptoplastie réelle. Un kleptoplaste, c’est un kleptomane qui ne peut pas s’empêcher de voler, avec une spécialité pour les plastes. (12)
Le premier organisme soupçonné dès 1876 (1) d’avoir ce genre de relations avec une algue, c’est Elysia chlorotica, un gastéropode marin de la famille des Sacoglosses. Complètement brun à la naissance, il devient vert en se nourrissant d’algues du genre Vaucheria. Les cellules des algues sont digérées, pendant que les chloroplastes sont soigneusement séquestrés bien à part, dans les cellules de l’épiderme de l’animal. Grâce à cette innovation, ils peuvent survivre en ne se nourrissant que 2 semaines par an, retenant les chloroplastes sous contrôle jusqu’à un an. Pour réaliser cet exploit, la limace a intégré dans son génome une partie des gènes de l’algue, permettant de commander la photosynthèse et le transport des protéines du chloroplaste. (13,14) La réaction de photosynthèse étant très toxique, car elle produit des petits déchets liés à l’oxygène (on appelle cela les espèces réactives de l’oxygène). Les plantes ont un pannel de composés et d’enzymes responsables de maintenir la cellule en état et de neutraliser ces substances – mais certaines Elysia comme Elysia timida elle peut assurer le repli de ses « ailes vertes » afin de limiter l’exposition solaire quand le besoin s’en fait sentir. Cela lui permet de choisir une dose sûre de bronzage et d’en profiter petit à petit. (15)
Les autres espèces de sacoglosses peuvent avoir des préférences alimentaires différentes et dans certains cas permettraient de contrôler des proliférations d’algues toxiques. Etudier ces interactions a donc un intérêt pour la conservation et la gestion d’espaces naturels. (16)

Un autre cas d’école est Mesodinium rubrum un cilié hétérotrophe qui occasionnellement peut voler les chloroplastes d’organismes pour devenir autotrophe et réquisitionner la photosynthèse (17). Une capacité que l’on appelle la mixotrophie. Un problème dans cette situation est que d’ordinaire, la photosynthèse ne peut s’effectuer sans la coordination entre les gènes du noyau de la cellule végétale et ceux contenus dans les plastes. Le cilié doit donc également voler les noyaux des organismes qu’il mange pour pouvoir garder le contrôle et l’usage des chloroplastes, on parle de « karyokleptie » de karyos =noyau et kleftis=voleur (18).

L’acquisition de la photosynthèse dans plusieurs groupes vivants montre donc que la réaction n’est plus l’apanage exclusif des plantes, car certains organismes se sont appropriés leur capacité.
Pourquoi se prendre pour une plante ?
Pour ceux qui n’ont pas réussi à atteindre ce degré de sophistication dans le crime et le vol de chloroplastes, il est toujours possible de se déguiser en plante ou de faire le job soi même et de trouver d’autres solutions pour utiliser l’énergie lumineuse.
On peut aisément penser aux Phyllies, dont l’aspect est irréprochable ce qui leur permet de se fondre dans le décor et d’échapper à leurs prédateurs.

Mais rassurez-vous, les plantes utilisent les mêmes stratégies de camouflage lorsqu’elles sont menacées. Je peux par exemple vous citer l’exemple de cette petite fritillaire (Fritillaria delavayi), dont les individus bruns se fondent parfaitement avec la couleur du sol et évitent ainsi d’être récoltées pour leurs bulbes, utilisés en médecine traditionnelle. (19)
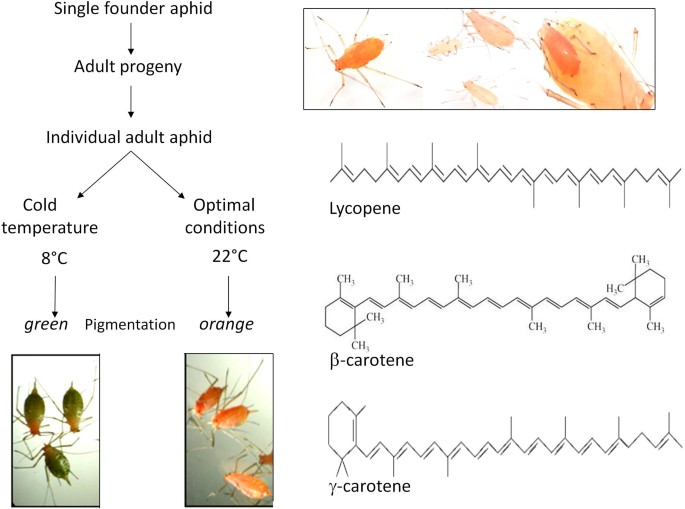
Que dire du puceron vert du pois (Acyrthosiphon pisum) ? Il serait le premier insecte à détenir dans son génome des gènes permettant de réaliser la photosynthèse sans avoir de chloroplastes, étant capable de fabriquer de l’énergie chimique sous la forme d’ATP grâce à des pigments caroténoïdes. Compte tenu du régime alimentaire extra-sucré des pucerons, les scientifiques se demandent quel intérêt ils auraient à avoir une source d’énergie supplémentaire. En attendant plus de réponses, admettons que c’est « juste au cas où » ! (20)
Certaines bactéries vertes sulfureuses sont même capables de ne pas utiliser la lumière du soleil, mais la lumière du magma océnique, à 2km de profondeur, grâce à des pigments proches de la chlorophylle nommés « bactériochlorophylles », stockées dans des « chlorosomes ». A découvrir dans cette vidéo. (21)


D’autres espèces comme le frelon oriental (Vespa orientalis) sont intrigantes. Ayant l’habitude de creuser leurs nids sous terre, avec des pics d’activité absolument corrélés à la luminosité du soleil, les scientifiques se sont rendus compte que les pigments de la cuticule de l’insecte servaient en quelque sorte de panneaux solaires. Le frelon absorberait notamment l’énergie via la bande jaune de son abdomen, grâce à un pigment appelé la xanthoptérine. (22)
A quand les « planimaux » ?
Ces recherches sont importantes pour plusieurs raisons. Comprendre la façon dont des organismes vivants peuvent s’accaparer des plastes d’autres espèces, ou du matériel génétique directement, permet d’une part d’avancer dans notre compréhension des mécanismes à l’oeuvre dans l’évolution et d’autre part de réfléchir à de possibles applications futures pour des symbioses plantes/animaux.
Les plastes en eux mêmes sont de vastes usines de fabrication de composés, et pas seulement pour la photosynthèse ! Ils sont importants pour la fabrication des lipides, de vitamines, de pigments… Pourrait-on créer des organismes capables de multiplier en laboratoire des plastes de production de substances d’intérêt économique ?
Certains chercheurs se penchent sur la réplication en laboratoire de fusion entre cyanobactéries et animaux. Ainsi, des tentatives d’injections de la bactérie photosynthétique Synechococcus elongatus ont-elles été réalisées dans des oeufs de poissons zèbres, avec plus ou moins de succès (23).
En théorie, trois approches pourraient être utilisées pour réaliser des « planimaux » :
- Pousser une cellule animale à absorber une algue et à la maintenir, comme ce qui a du se produire lors de l’endosymbiose primaire
- Introduire l’algue directement dans une cellule animale par microinjection
- Reprogrammer le génome d’une cellule ou réaliser un génome synthétique hybride entre une algue et un animal, capable de créer lui même un appareil photosynthétique fonctionnel.

Aucune de ces méthodes n’est aisée, mais l’approfondissement des exemples disponibles dans le vivant donnera des pistes pour parvenir un jour à cette ambitieuse association. (24)
Le transfert des plastes est en tout cas très étudiés, certains chercheurs avancent même que des plantes parasites d’autres plantes (ex : la Rafflesia qui vit sur des vignes du genre Tetrastigma) seraient capables de substituer des chloroplastes dans leurs opérations de parasitisme ! (25)
La dernière question que l’on peut se poser, c’est évidemment à la suivante : Pourrait-on faire du respirianisme dans le futur, carburant uniquement à l’air et au soleil ? Cela nous rendrait bien sûr indépendants de tout les aspects terre à terre de la vie quotidienne (faire ses courses en supermarché, cuisiner, manger, déféquer) et pourquoi pas d’enfin voyager dans l’espace sans avoir besoin de cultiver des plantes dans l’espace ?
Mais que les biohackers du monde entier ne s’excitent pas trop, car il y a quelques problèmes à résoudre avant d’en arriver à l’hybride parfait plante-animal.
Tout d’abord, l’énergie requise pour maintenir et multiplier un chloroplaste dans une cellule humaine serait très importante. Même l’Elysie ne garde ses chloroplastes que quelques mois, tout au plus, avant de les dégrader.
Ensuite, le métabolisme des chloroplastes seuls ne permettrait pas de créer l’ensemble des nutriments dont nous avons besoin dans notre alimentation. Il faudrait donc compenser en rajoutant des voies de synthèse chimique… ce qui n’est pas une mince affaire, compte tenu de la complexité du métabolisme !
Terminons par d’autres considérations matérielles : d’une part, pour produire cette quantité d’énergie phénoménale, les plantes ont une énorme surface d’exposition au soleil grâce à leurs feuilles. Pour augmenter encore le rendement d’absorption, les chloroplastes tournent dans la cellule, dans un phénomène que l’on appelle la cyclose, s’assurant ainsi un maximum de lumière. La surface d’absorption de notre peau, en comparaison est totalement ridicule. Pour vous donner un ordre de grandeur, on pourrait s’en sortir à 2 mètres carrés de peau (donc une grande partie est recouverte de vêtements), contre 200 hectares recouverts (soit la surface de Monaco) avec les feuilles d’un seul arbre de 15 mètres de haut, selon cet article.

L’un des problèmes majeur sera aussi de se fournir en CO2 ! Les plantes absorbent ce gaz via des ouvertures, les stomates, constituées de deux cellules stomatiques et ouvertes sur ce que l’on appelle l’ostiole. Elles sont capables de s’ouvrir et de fermer en variant la pression de la vacuole, une poche d’eau présente dans chaque cellule végétale. Notre peau quant à elle est hermétique, ou presque… ne permettant pas théoriquement cet afflux massif de gaz.
Pour finir… si vous étiez tentés pour devenir un planimal, j’espère que vous réalisez qu’il vous faudra accepter de ressembler à Gamora dans les gardiens de la Galaxie.

Le soleil au petit déjeuner, ce n’est pas encore pour demain ! Restons-en à notre bon croissant et bol de chicorée !
Je vous quitte sur ce gif d’amibe absorbant le chloroplaste rubané d’une algue Spirogyre. Les chloroplastes… tout le monde se les arrache !

Pour aller plus loin :
- Solymosi, K., Lethin, J. & Aronsson, H. Diversity and Plasticity of Plastids in Land Plants. in Plastids: Methods and Protocols (ed. Maréchal, E.) 55–72 (Springer US, 2018). doi:10.1007/978-1-4939-8654-5_4.
- Sheue, C.-R. et al. Bizonoplast, a unique chloroplast in the epidermal cells of microphylls in the shade plant Selaginella erythropus (Selaginellaceae). Am J Bot94, 1922–1929 (2007). (DOI : 10.3732/ajb.94.12.1922)
- Jacobs, M. et al. Photonic multilayer structure of Begonia chloroplasts enhances photosynthetic efficiency. Nature Plants2, 1–6 (2016). (DOI : 10.1038/nplants.2016.162)
- Brillouet, J.-M. et al. The tannosome is an organelle forming condensed tannins in the chlorophyllous organs of Tracheophyta. Ann Bot112, 1003–1014 (2013). (DOI : 10.1093/aob/mct168)
- Brillouet, J.-M. et al. Phenol homeostasis is ensured in vanilla fruit by storage under solid form in a new chloroplast-derived organelle, the phenyloplast. J Exp Bot65, 2427–2435 (2014). (DOI : 10.1093/jxb/eru126)
- Gunning, B., Koenig, F. & Govindjee, P. M. P. J. A dedication to pioneers of research on chloroplast structure. in (Springer, 2006). (ISBN : 978-1-4020-4060-3)
- McFadden, G. I. Primary and Secondary Endosymbiosis and the Origin of Plastids. Journal of Phycology37, 951–959 (2001). (DOI : https://doi.org/10.1046/j.1529-8817.2001.01126.)
- Burns, J., Zhang, H., Hill, E., Kim, E. & Kerney, R. Transcriptome analysis illuminates the nature of the intracellular interaction in a vertebrate-algal symbiosis. eLife6, (2017). (DOI : 10.7554/eLife.22054)
- Kerney, R. Symbioses between salamander embryos and green algae. Symbiosis54, 107–119 (2011). (DOI : 10.1007/s13199-011-0134-2)
- Kerney, R. et al. Intracellular invasion of green algae in a salamander host. PNAS108, 6497–6502 (2011). (DOI : 10.1073/pnas.1018259108)
- Ruppert, E. E. Invertebrate Zoology. (Cengage Learning India Private Limited, 2004).
- Clavijo, J. M., Donath, A., Serôdio, J. & Christa, G. Polymorphic adaptations in metazoans to establish and maintain photosymbioses. Biological Reviews93, 2006–2020 (2018). (DOI : 10.1111/brv.12430)
- Pelletreau, K. N., Worful, J. M., Sarver, K. E. & Rumpho, M. E. Laboratory culturing of Elysia chlorotica reveals a shift from transient to permanent kleptoplasty. Symbiosis58, 221–232 (2012). (DOI : 10.1007/s13199-012-0192-0)
- Schwartz, J. A., Curtis, N. E. & Pierce, S. K. FISH labeling reveals a horizontally transferred algal (Vaucheria litorea) nuclear gene on a sea slug (Elysia chlorotica) chromosome. Biol Bull227, 300–312 (2014). (DOI : 10.1086/BBLv227n3p300)
- Cartaxana, P. et al. The photon menace: kleptoplast protection in the photosynthetic sea slug Elysia timida. The Journal of Experimental Biology222, (2019). (DOI : 10.1242/jeb.202580)
- Middlebrooks, M., Gowacki, W., Bell, S. & Pierce, S. Annual occurrence and algal preferences of the kleptoplastic sea slug, Elysia papillosa. Symbiosis77, (2019). (DOI : 10.1007/s13199-018-00592-1)
- The Amazing Acquired Phototroph! https://www.whoi.edu/https://www.whoi.edu/oceanus/feature/the-amazing-acquired-phototrophs/.
- .Johnson, M. Acquired Phototrophy in Ciliates: A Review of Cellular Interactions and Structural Adaptations1. The Journal of eukaryotic microbiology58, 185–95 (2011). (DOI : 10.1111/j.1550-7408.2011.00545.x)
- .Niu, Y., Stevens, M. & Sun, H. Commercial Harvesting Has Driven the Evolution of Camouflage in an Alpine Plant. Current Biology0, (2020). (DOI : 10.1016/j.cub.2020.10.078)
- Valmalette, J. C. et al. Light- induced electron transfer and ATP synthesis in a carotene synthesizing insect. Scientific Reports2, 579 (2012). (DOI : 10.1038/srep00579)
- Beatty, J. T. et al. An obligately photosynthetic bacterial anaerobe from a deep-sea hydrothermal vent. PNAS102, 9306–9310 (2005). (DOI : 10.1073/pnas.0503674102)
- Plotkin, M. et al. Solar energy harvesting in the epicuticle of the oriental hornet (Vespa orientalis). Naturwissenschaften97, 1067–1076 (2010). (DOI : 10.1007/s00114-010-0728-1)
- Agapakis, C. M. et al. Towards a Synthetic Chloroplast. PLOS ONE6, e18877 (2011). (DOI : 10.1371/journal.pone.0018877)
- Matsunaga, S. Planimal Cells: Artificial Photosynthetic Animal Cells Inspired by Endosymbiosis and Photosynthetic Animals. CYTOLOGIA83, 3–6 (2018). (DOI : 10.1508/cytologia.83.3)
- Krause, K. Grand-scale theft: Kleptoplasty in parasitic plants? Trends in Plant Science20, 196–198 (2015). (DOI : 10.1016/j.tplants.2015.03.005)



